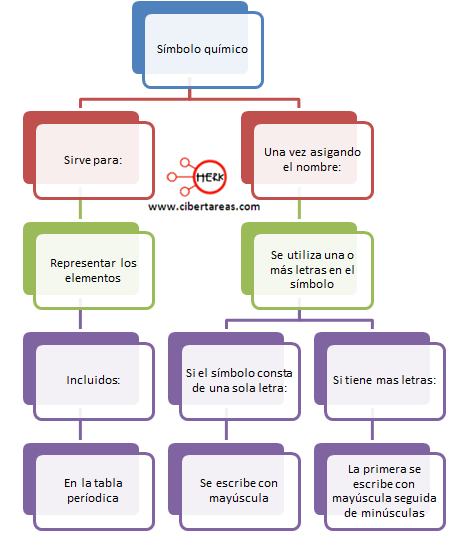
SIMBOLOGÍA QUÍMICA
Para representar una reacción química se emplean símbolos que constituyen lo que se conoce con el nombre de ECUACIÓN QUÍMICA.
En una ecuación química aparece una flecha que indica cambio, y se lee PRODUCE; al lado izquierdo de la flecha están los REACTIVOS (MATERIAS PRIMAS), que son las sustancias que reaccionan. Al lado derecho se encuentran los productos que son las sustancias que se obtienen después de la transformación química.
SÍMBOLOS USADOS EN ECUACIONES QUÍMICAS:
EJEMPLO:
3 moles de ... ácido carbonoso en estado gaseoso reacciona con 2 moles de hidróxido de aluminio en estado acuoso, para producir carbonito de aluminio en estado solido mas 6 moles de agua en estado liquido.
ACTIVIDAD:
2 Moles de carbonato ácido de sodio, en estado solido, se descompone para producir carbonato de sodio , mas agua en estado gaseoso mas oxido carbonoso en estado gaseoso. Requiere de adiccion de agua.
*2 moles de aluminio en estado solido se combinan con tres moles de cloro es estado gaseoso para producir dos moles de cloruro de aluminio en estado solido.
* hidróxido magnesio en estado acuoso se combinan con dos moles de ácido clorhídrico en estado acuoso para producir 1 mol de cloruro de magnesio ... en estado solido mas 1 mol de agua en estado liquido.
Para representar una reacción química se emplean símbolos que constituyen lo que se conoce con el nombre de ECUACIÓN QUÍMICA.
En una ecuación química aparece una flecha que indica cambio, y se lee PRODUCE; al lado izquierdo de la flecha están los REACTIVOS (MATERIAS PRIMAS), que son las sustancias que reaccionan. Al lado derecho se encuentran los productos que son las sustancias que se obtienen después de la transformación química.
SÍMBOLOS USADOS EN ECUACIONES QUÍMICAS:
metal + OH
--------------------------------
Hidróxido
hidrógeno + no metal
------------------------------------
ácido hidrácido
metal+ no metal
---------------------------------
sal
metal + no metal+ O2
-------------------------------------
sal
H+ no metal + O2
----------------------------------------
ácido; ico. oso
Sal; ito- ato
*Ejemplos:

video:https://www.youtube.com/watch?v=ypG4xvRrirE
caricatura:https://www.pixton.com/es/schools/comic-strip/4dayovk0
juego:https://es.educaplay.com/es/recursoseducativos/3269610/simbologia_quimica.htm
EJEMPLO:
3 moles de ... ácido carbonoso en estado gaseoso reacciona con 2 moles de hidróxido de aluminio en estado acuoso, para producir carbonito de aluminio en estado solido mas 6 moles de agua en estado liquido.
ACTIVIDAD:
2 Moles de carbonato ácido de sodio, en estado solido, se descompone para producir carbonato de sodio , mas agua en estado gaseoso mas oxido carbonoso en estado gaseoso. Requiere de adiccion de agua.
*2 moles de aluminio en estado solido se combinan con tres moles de cloro es estado gaseoso para producir dos moles de cloruro de aluminio en estado solido.
* hidróxido magnesio en estado acuoso se combinan con dos moles de ácido clorhídrico en estado acuoso para producir 1 mol de cloruro de magnesio ... en estado solido mas 1 mol de agua en estado liquido.
vídeo de simbologia química https://www.youtube.com/watch?v=phAvpdylgbc
CLASES DE REACCIONES QUIMICAS
1 SINTESIS O COMBINACION :
Ejemplo:
En estas ecuaciones reaccionan dos o mas reactivos para formar un solo producto.
2 REACCIONES DE DESCOMPOSICIÓN :
Ejemplo:
Es una reacción de descomposición de un compuesto se obtienen 2 o mas sustancias simples.
3 REACCIÓN DE DESPLAZAMIENTO SIMPLE:
Ejemplo:
En estas reacciones un elemento reacciona con un compuesto y toma el lugar de un elemento en dicho compuesto .
4 REACCIONES DE DESPLAZAMIENTO DOBLE :
Ejemplo:

















Comentarios
Publicar un comentario